|
|||||||
|
|
|
 |
|
|
Strumenti |
|
|
#961 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
La nitroglicerina si decompone isecondo la reazione nn bilanciata
C3H5N3O9(liq)--->CO2(g)+H2O(g)+N2(g)+O2(g). Calcolare la quantità di calore che entra in gioco quando si fanno esplodere 200 g di nitroglicerina (deltaH°f=-58Kcal\mol) 1°abbiamo bilanciato la reazione 2°abbiamo convertito in Kcal i DeltaH°f dei prodotti 3°abbiamo usato la formula di Hess per calcolare il DeltaH° 4°abbiamo trovato quante moli sono 200g di nitroglicerina 5°abbiamo moltiplicato il deltaH° trovato per il numero di moli di nitro 6°il conto nn ci viene |
|
|

|
|
|
#962 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6818
|
Siete sicuri di aver utilizzato correttamente Hess?
|
|
|

|
|
|
#963 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
il proicedimento però era giusto??
noi abbiamo utilizzato questa 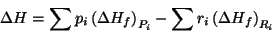
|
|
|

|
|
|
#964 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6818
|
Il procedimento è quello giusto, la formula anche.. però se postassi i calcoli magari riuscirei a capire dove si trova l'errore.
|
|
|

|
|
|
#965 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
2(C3H5N3O9)-->6(CO2)+5(H2O)+1/2(O2)+3(N2)
trasformazione Kj-->Kcal CO2-->-393.5KJ*0.23=-90.5Kcal/mol H2O-->-241.8*0.23=-55.61Kcal/mol formula di Hell delta H°=5*(-55.61)+6*(-90.5)-(2*(-58))=705Kcal/mol essendo 200 g di nitro-->227g/mol abbiamo 0.88 mol Quindi -705.1*0.88=620.4Kcal Il risultato della prof è invece -324.7 Kcal. P.S. prima o poi imparero il latex |
|
|

|
|
|
#966 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6818
|
allora.. anzitutto il conto è sbagliato ( a me viene 715 ). Poi.. quello è il calore generato da DUE moli di nitroglicerina, quindi devi dividerlo per due e successivamente moltiplicarlo per 0.88.
|
|
|

|
|
|
#967 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
|
|
|

|
|
|
#968 |
|
Senior Member
Iscritto dal: Aug 2005
Città: prov di NA
Messaggi: 827
|
|
|
|

|
|
|
#969 |
|
Senior Member
Iscritto dal: Oct 2006
Città: Davanti ad un pc
Messaggi: 3615
|
Salve amici.
Mi spiegate cosa vogliono significare le sigle che si usano per le sostanze da laboratorio ? Ad esempio leggo su un libro : "far reagire una quantità costante di acido cloridrico HCl 0.73 g 20 mL 1M con..." Cosa indicano i numeri 0.73g 20mL 1M ? La prima (0.73g) credo di averla capita,è la quantità in grammi di HCl che si vuole usare nella reazione. Ma le altre 2 sigle cosa indicano ?
__________________
Il mio computer - Il mio muletto - Thread ufficiali : Windows 10 - Windows 11 - Blog Windows - Mozilla Firefox - Mozilla Thunderbird - Libreoffice - Software portabile installationless gratuito ! |
|
|

|
|
|
#970 | |
|
Senior Member
Iscritto dal: Feb 2007
Città: Treviso provincia
Messaggi: 2927
|
Quote:
1 M = 1 molare = 1 mol/Kg = 1 mole di soluto per ogni litro di solvente 1 mole indica il numero di molecole (6.022*10^23). per conoscere la massa di una mole devi conoscere il peso molecolare del composto (o peso atomico dell'elemento) in questione. Codice:
m = PM * n in questo caso stranamente è stata specificata sia una misura di massa che di volume. una delle due è superflua e solitamente non si scrive. dato che HCl si trova praticamente sempre in soluzione acquosa si usano misure di volume. a un certo volume a una data concentrazione corrisponde una precisa quantità di massa. in questo caso puoi verificare che: Codice:
Conc. in grammi litro = M * PM = (1 mol/l) * (36,5 g/mol) = 36,5 g/l m = conc.gl * V = (36,5 g/l) * (0,02 l) = 0,73 g M molarità in mol/l m massa in grammi V volume in litri ti consiglio di studiare sui libri e di fare degli esercizi finchè non ti saranno ben chiare queste cose basilari. ciao
__________________
Codice:
BUSINESS: obelix-it 4x,chavez_amd,raulnet,maskabe 2x,dobermann75, nicola80,antanio,vitux,sirioo,galaverna,gonfaloniere,ste_ita,foremanzo,g0ldf3n1x, marcy1987,fiorigic,detroit,ercagno,bustonèr,licaone, adriannox,charlie77,xleaaz,crystal dragon,mabocrack,Cyfer73,drive97,pasqualaccio,Talpa88, Alex3oo1,aceomron,xbax88,accord62,oldfield 2x, leyfon,sallival,cos1950,nano_Sardo,Tecnomania01,Smanet |
|
|
|

|
|
|
#971 | |
|
Senior Member
Iscritto dal: Dec 2003
Città: Trento, Pisa... ultimamente il mio studio...
Messaggi: 4369
|
Quote:
Non è che studi a Pisa?
__________________
"Expedit esse deos, et, ut expedit, esse putemus" (Ovidio) Il mio "TESSORO": SuperMicro 733TQ, SuperMicro X8DAI I5520, 2x Xeon Quad E5620 Westmere, 12x Kingston 4GB DDR3 1333MHz, 4x WD 1Tb 32MB 7.2krpm 
|
|
|
|

|
|
|
#972 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
|
|
|

|
|
|
#973 |
|
Junior Member
Iscritto dal: Jul 2008
Messaggi: 11
|
help imminente esame di chimica
cia a tutti,vi scrivo perchè sono iscritta alla faacoltà di ingegneria elettronica ma sono una capra in chimica
NB. di un paio di questi problemi ho trovato la soluzione proprio in questo forum, alle prima 4 pagine, ma sinceramente non ho ben capito lo svolgimento, di altri non sono neanche sicura che siano ben forumulati (la prof è pazza). 1. Un certo metallo forma due composti con il cloro (massa atomica del Cloro 35.5). I due composti contengono rispettivamente l’85.2% e il 65.8% del metallo. a. Quali sono le formule che avrebbe assegnato Dalton (regola della massima semplicità) ai due composti? E quale sarebbe la massa atomica del metallo b. Considerando altre possibili formule, quali altre masse atomiche sono ipotizzabili? 2. Un composto binario gassoso contenente azoto ha una densità relativa all’azoto pari a 2.53 a 100°C e alla pressione di 1 atm. Facendo reagire 8.21g di questo gas con AlCl3 a 100°C tutto l’azoto contenuto nel composto si trasforma in 1.62 g di azoto (N2 ) gassoso. a. Stimare la massa molecolare del composto b. Determinare il numero di atomi di N presenti nella molecola del composto c. Qual’è il massimo valore possibile per la massa atomica del secondo elemento? d. Sono possibili altri valori per la massa atomica del secondo elemento? e. Determinare la formula molecolare del composto 3. Alla temperatura di 450°C due contenitori rigidi del volume di 10.0 e 5.00L contengono rispettivamente azoto gassoso alla pressione di 1 atm e idrogeno gassoso alla pressione di 3 atm. I due recipienti sono separati da una parete. Quando questa parete viene rimossa i due gas si mescolano e avviene la reazione di formazione dell’ammoniaca. N2(g)+3H2(g)<->2NH3(g) Prevedere, alla temperatura di 450°C: a. la pressione che segna un manometro collegato al recipiente prima che la reazione abbia inizio b. la pressione che segnerebbe il manometro se la reazione avvenisse completamente c. la pressione che segnerebbe il manometro se solo il 40% dell’idrogeno contenuto inizialmente nel recipiente si trasformasse in ammoniaca. 4. Alla temperatura di 613K avviene la seguente reazione di equilibrio: Fe2O3(s)+3H2(g)<->2Fe(s)+3H20 A questa temperatura, in un recipiente di 10.0L vengono introdotti 100,0g di Fe2O3(s) ed una pressione parziale di H2(g) pari ad 1.00 atmosfere. Si verifica che a trasformazione avvenuta si sono formati 4,50g di Fe(s). Si richiede la composizione qualitativa e quantitativa del sistema, ad equilibrio raggiunto. 5. Determinare in quale delle strutture (cubica semplice, cubica a corpo centrata, cubica a facce centrate) cristallizza il Ni metallico sapendo che: il lato della cella elementare è a=0.3524nm , la densità del Nichel è 8.900g/cm^3 e la massa atomica del Nichel è 58,69gmol-1 6. Una miscela gassosa formata da metano CH4 e acetilene C2H2 all’interno di un recipiente rigido esercita, ad una certa temperatura, una pressione di 63.0 torr. Se questa miscela brucia avvengono le seguenti reazioni: 2C2H2(g)+5O2(g)->4CO2(g)+2H2O(g) CH4(g)+2O2(g)->CO2(g)+2H2O(g) Raccogliendo solo l’anidride carbonica gassosa (CO2 ) prodotta si riscontra che la pressione esercitata da questo gas nello stesso volume e alla stessa temperatura della miscela originale è di 96.0 torr. Calcolare la frazione molare di CH4 nella miscela originaria. 7. Introducendo 30,0g di Cu in 0,500 litri di soluzione acquosa di acido nitrico avviene la seguente reazione 3Cu(s)+8HNO3(aq)->3Cu(NO3)2(aq)+2NO(g)+4H2O se i reagenti sono in quantità stechiometrica determinare la concentrazione della soluzione di acido nitrico che si è utilizzata. 8. La solubilità in acqua del NaCl è del 30% in peso ad una certa temperatura e la soluzione satura ha una densità di 1.15g mL-1 . Calcolare quanti grammi di NaCl è necessario aggiungere a 500 mL di una soluzione 0.50 M di NaCl perché diventi satura assumendo che la soluzione, per aggiunta del sale, subisce un incremento di volume del 10%. 9. La tensione di vapore del benzene liquido (C6H6) vale 94.7 torr a 25°C. In un recipiente vuoto rigido del volume di 5.00 L si introduce a 25°C una quantità di benzene gassoso tale da prevedere che un manometro collegato al recipiente segni una pressione di 200 torr. Determinare la composizione qualitativa e quantitativa del sistema in queste condizioni nell’ipotesi che il volume a disposizione della fase gassosa sia sempre 5.00L 10. Analizzare e discutere tutti i parametri che influenzano la temperatura critica delle due sostanze NH3 e PH3 e concludere se è possibile prevedere quale delle due sostanze ha la temperatura critica più elevata. 11. Un certo elemento metallico M forma con il cloro il Composto MCl2. La percentuale di Cloro in questo composto è del 44,7 % . Qual è il Metallo M? 12. Il Ciclopropano è un idrocarburo gassoso (sostanza formata solo da Idrogeno e Carbonio) utilizzato come anestetico. 0,45L di Ciclopropano reagendo con la adeguata quantità di Ossigeno si trasformano completamente in 1,35L di Anidride Carbonica e 1,35L di vapor d’acqua. Tutti i volumi sono misurati alla stessa temperatura e pressione. Determinare la formula molecolare del Ciclopropano 13. Un composto è costituito dal 40% in peso di Carbonio, dal 53% di Ossigeno e dal 6,67% di Idrogeno. La densità del composto gassoso misurata alla temperatura di 0°C e 1atm vale 2,68gL-1. Determinare la formula molecolare del Composto 14. Alla temperatura di 75°C il solfito di rubidio solido Rb2 SO3(s) reagisce con l’acido bromidrico gassoso HBr(g) secondo la seguente reazione: Rb2 SO3(s) + 2HBr(g) -> 2RbBr(s) + H2SO3(l) Se 6,24g di Rb2 SO3(s) reagiscono con 1,38L di HBr(g) misurati alla temperatura di reazione e alla pressione di 0,953atm, formando 7,28g di RbBr(s). Determinare la composizione qualitativa e quantitativa del sistema a reazione conclusa. 15. In un recipiente rigido si introducono Idrogeno e Ossigeno gassosi, entrambi alla pressione parziale di 0,9atm. Alla temperatura T avviene la seguente reazione: 3H2(g) + N2(g) -> 2NH3(g) Calcolare la frazione molare di tutte le sostanze presenti nel sistema sapendo che, a trasformazione avvenuta, un manometro collegato al recipiente di reazione segna una pressione di 1,6atm alla temperatura T 16. Il Polonio metallico cristallizza in una cella cubica semplice. Calcolare il raggio atomico (approssimativo) dell’atomo di Polonio sapendo che la sua densità è 9,142 gmL-1 17. La solubilità del KCl in acqua alla temperatura T1 è 4,3M e alla temperatura T2 è il 20% in peso. 200g di soluzione satura a T1 [densità 1,17 gmL^(-3) ] sono portati alla temperatura T2. Determinare la composizione qualitativa e quantitativa del sistema alla temperatura T2. 18. Mescolando un determinato volume V di una soluzione acquosa di NaI 0,25M con 45mL di una soluzione di Hg(NO3)2 0,10M avviene la seguente reazione: 2NaI(aq) + Hg(NO3)2(aq) -> HgI2(s) + 2NaNO3(aq) e il nitrato di mercurio, Hg(NO3)2 contenuto nella soluzione si consuma completamente. Calcolare il volume V. Se, a reazione avvenuta, evapora acqua dal sistema di reazione, ad un determinato valore del volume della soluzione comincia a precipitare il NaNO3. Calcolare il valore di questo volume, sapendo che la solubilità in acqua del NaNO3 è 7,60M. 19. Perché in un recipiente del volume di 136,0L sia presente solo vapore acqueo saturo a 25°C bisogna iniettare 3,006g di H2O(l) Determinare la composizione qualitativa e quantitativa del sistema se il volume del sistema viene ridotto alla metà. [si consideri la densità dell’acqua liquida CIRCA 1,00gmL-1]. |
|
|

|
|
|
#974 | |
|
Member
Iscritto dal: Sep 2005
Città: A casa mia...
Messaggi: 169
|
Quote:
Mi sono permesso di correggere e aggiungere qualche cosa (in grassetto). I calcoli non li ho guardati, scusate se ho scritto qualche minchiata ma ho troppo sonno (liberi di fustigarmi, in tal caso  ). Ciao ). Ciao |
|
|
|

|
|
|
#975 | |
|
Senior Member
Iscritto dal: Feb 2007
Città: Treviso provincia
Messaggi: 2927
|
Quote:
grazie per la correzione, sono dettagli importanti 'notte
__________________
Codice:
BUSINESS: obelix-it 4x,chavez_amd,raulnet,maskabe 2x,dobermann75, nicola80,antanio,vitux,sirioo,galaverna,gonfaloniere,ste_ita,foremanzo,g0ldf3n1x, marcy1987,fiorigic,detroit,ercagno,bustonèr,licaone, adriannox,charlie77,xleaaz,crystal dragon,mabocrack,Cyfer73,drive97,pasqualaccio,Talpa88, Alex3oo1,aceomron,xbax88,accord62,oldfield 2x, leyfon,sallival,cos1950,nano_Sardo,Tecnomania01,Smanet Ultima modifica di v1nline : 19-07-2008 alle 02:14. |
|
|
|

|
|
|
#976 |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
3) Una soluzione di 5 g di sale in 150 g di acqua bolle a 100,25 °C. Calcolare il numero di ioni in cui si dissocia il sale, sapendo che il suo peso molecolare è 136. La costante ebullioscopica dell’acqua è 0,512 K mol-1 Kg.
Io sinceramente nn la minima idea di cosa voglia, quanlcuno me lo spiega cortesemente? La risposta è i =2 e che cosa intende con i? |
|
|

|
|
|
#977 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6818
|
http://it.wikipedia.org/wiki/Propriet%C3%A0_colligativa
Δ Teb = Keb · m · i i è il numero di ioni che ogni molecola di sale ti libera. per il resto è semplice.. calcoli la molalità, calcoli Δ Teb e trovi i |
|
|

|
|
|
#978 | |
|
Senior Member
Iscritto dal: Jun 2007
Messaggi: 1618
|
Quote:
 è la prima volta che vedo questa formula è la prima volta che vedo questa formula
|
|
|
|

|
|
|
#979 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6818
|
Beh, se vuoi c'è quella completa, col coefficiente di van' t Hoff

|
|
|

|
|
|
#980 | |
|
Senior Member
Iscritto dal: Feb 2007
Città: Treviso provincia
Messaggi: 2927
|
Quote:
 
__________________
Codice:
BUSINESS: obelix-it 4x,chavez_amd,raulnet,maskabe 2x,dobermann75, nicola80,antanio,vitux,sirioo,galaverna,gonfaloniere,ste_ita,foremanzo,g0ldf3n1x, marcy1987,fiorigic,detroit,ercagno,bustonèr,licaone, adriannox,charlie77,xleaaz,crystal dragon,mabocrack,Cyfer73,drive97,pasqualaccio,Talpa88, Alex3oo1,aceomron,xbax88,accord62,oldfield 2x, leyfon,sallival,cos1950,nano_Sardo,Tecnomania01,Smanet |
|
|
|

|

|
| Strumenti | |
|
|
Tutti gli orari sono GMT +1. Ora sono le: 11:39.