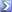|
|||||||
|
|
|
 |
|
|
Strumenti |
|
|
#21 | |||
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
Quote:
Quote:
cosa intendi per lavoro massimo? In una compressione reversibile ad esempio lungo una isoterma, il lavoro è dato da 
|
|||
|
|

|
|
|
#22 |
|
Senior Member
Iscritto dal: Sep 2006
Messaggi: 3398
|
La butto lì: potrebbe dipendere dal fatto che il calore specifico (o capacità termica che dir si voglia) a pressione costante è diverso da quello a volume costante (per un gas perfetto)?

__________________
Intel i7-4790K - GIGABYTE Geforce 1080 ti - 16 GB DDR3 1600 - MSI Z97 Gaming 5 - Samsung 850 EVO 500 Gb
2 x WD Blue 4 Tb RAID 1 - Asus Xonar DSX - LiteOn iHBS112 - Seasonic S12II-620 Bronze - LG 32GK850G GSync |
|
|

|
|
|
#23 | |
|
Senior Member
Iscritto dal: Jan 2006
Città: Vergate Sul Membro (MI)
Messaggi: 16538
|
a parte il pasticcio coi quote...
Quote:
come giustamente osservi in una compressione reversibile il lavoro è dato da:  Perchè questo!? Proprio perchè la trasformazione è reversibile. in questo momento ti odio perchè non amo pensare L'integrale qui sopra è stato ottenuto dalla equazione ( o legge ) di stato dei gas ideali. Tale legge è una astrazione matematica operata a partire da 3 leggi sperimentali sui gas relative alle 3 trasformazioni isocora isobara e isoterma. L'astrazione è un modello "attendibile" soltanto se vengono soddisfatte alcune ipotesi, che richiedono che le grandezze in questione siano grandezze "globali" ( le ipotesi sono diverse e fisicamente puntuali, quella che ho indicato è solo la conseguenza "in soldoni" ) vale a dire che temperatura e pressione devono essere uniformi nel gas cioè indipendenti dalla posizione. Questo porta a definire la legge di stato dei gas, il concetto di trasformazione "reversibile" e di lavoro come visto sopra. Considerazioni strettamente termodinamiche portano poi alla scoperta che nel caso reale la legge di stato e tutte le altre belle cosette non valgono. Questo deriva proprio dal fatto che la pressione e la temperatura non sono grandezze uniformi. Per tale ragione si ottiene che l'energia del gas non è data solo da calore e lavoro ma anche da entropia, cioè il caos. si passa cioè da questa dU = δQ − δL che può scriversi anche dQ = cvdT + pdv a questa dU ≥ δQ − δL che può scriversi con l'uguale se si include la entropia http://it.wikipedia.org/wiki/Gas_ideale http://it.wikipedia.org/wiki/Entropia_(termodinamica) ( questa è termodinamica di liceo eh... niente di arcano la trovi anche sul chiorboli, comunque credo che lucrezio, che è ben più autorevole di me, ti possa confermare ) detto questo abbiamo che nel caso di una trasformazione reale essa non è reversibile, ( perchè non possiamo riprodurre esattamente la configurazione di temperature e pressioni nei vari punti del gas ) l'entropia è maggiore di zero, quindi se l'energia totale del gas si conserva, ( sistema isolato ) allora parte del calore si converte in entropia e non in lavoro. questo è alla base del perchè il lavoro è massimo in una trasformazione reversibile. per quanto riguarda il piano pv: il piano pv è il piano utilizzato per graficare la legge di stato dei gas perfetti. questa: 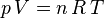 questa legge ha 3 variabili P V e T: sul piano P V si riportano pressione e volume ( esistono anche i piani T V e P T ) mentre la terza variabile è un parametro cioè è costante. inoltre è sempre possibile esprimere una delle 3 variabili in funzione delle altre 2 per questo un punto del piano individua 3 coordinate: pressione volume e temperatura ( proprio perchè una dipende dalle altre due ) per tale ragione: la curva che esprime la pressione p in funzione del volume v descrive una trasformazione a temperatura costante e cioè isoterma la curva che esprime t in funzione di v è a pressione costante e cioè isobara la curva che descrive la temperatura in funzione della pressione è a volume costante e cioè isocora Se il grafico è quello che hai postato ed è un piano pv, la linea orizzontale individua dei punti tutti alla stessa pressione, quindi è una curva a pressione costante (isobara); la linea verticale individua punti associati tutti allo stesso volume, quindi è un'isocora le tre curve nel loro complesso rappresentano un ciclo termodinamico ideale (manca il verso di percorrenza ) esattamente come il ciclo di carnot, per intenderci. quindi le considerazioni sono quelle per un ciclo termodinamico. questo naturalmente è solo la premessa, per poter fare un ragionamento sensato, altrimenti tanto vale parlare di mele pere e cavalleggeri prussiani (cit.) appena posso ti posto un pdf di termodinamica, per intanto http://it.wikipedia.org/wiki/Ciclo_termodinamico ho trovato delle dispense degne di nota http://enrg55.ing2.uniroma1.it/downl...modinamica.pdf vengono trattate anche i bilanci energetici dei sistemi. quindi hai tutta la teoria che ti spiega come varia l'energia ( che è lavoro ) nel gas a pressione costante o a volume costante Ultima modifica di hibone : 09-11-2007 alle 15:55. |
|
|
|

|
|
|
#24 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Mi sa che non ci siamo capiti per la ennesima volta
 So perfettamente quali siano le linee che rappresentano isocora/bara/terma. Se in quell'integrale supponi che P sia costante ( è la pressione esterna, la trasformazione è isoterma, non isobara!!!) puoi integrare, e il lavoro dipende SOLO dagli estremi di integrazione! Ed è qui che voglio capire.. se impongo una pressione esterna più alta di quella minima per compiere una trasformazione isoterma da V1 a V2 cosa succede al gas? Si scalda, aumenta la sua temperatura e in funzione del fatto che è isoterma cede calore? forse è meglio se i grafici li disegno e poi li scannerizzo. Ps belle le dispense, ma sono già sepolto dalle mie, più ovviamente il libro Ultima modifica di stbarlet : 09-11-2007 alle 16:03. |
|
|

|
|
|
#25 | |
|
Senior Member
Iscritto dal: Jun 2004
Messaggi: 1364
|
Quote:
cmq una trasformazione dove la pressione esterna è diversa da quella interna istantaneamente non è una trasformazione reversibile, quindi non può essere rappresentata nel piano PV, quindi non puoi parlare di lavoro della pressione esterna come l'area sottesa sotto il grafico della funzione. Ultima modifica di T3d : 09-11-2007 alle 16:17. |
|
|
|

|
|
|
#26 | |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
E non capisco perchè non possa esistere una TRASFORMAZIONE isotermica a pressione esterna costante! La letteratura ne è stracolma! Ultima modifica di stbarlet : 09-11-2007 alle 16:40. |
|
|
|

|
|
|
#27 |
|
Senior Member
Iscritto dal: Jun 2004
Messaggi: 1364
|
|
|
|

|
|
|
#28 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
|
|
|

|
|
|
#29 | |
|
Senior Member
Iscritto dal: Jan 2006
Città: Vergate Sul Membro (MI)
Messaggi: 16538
|
Quote:
 ) )se non viene specificato altrimenti la pressione P la temperatura T e il volume V dell'integrale sono quelle del gas nel cilindro, o dico male?! si poi introduci una variabile in più ( la pressione esterna) , ti serve un vincolo per legarla alle 3 variabili che già hai, senno quello che stai cercando di fare diventa calcolare il lavoro per spostare una massa sulla superficie terrestre supponendo costante la gravità su giove... ps. magari posta il testo del problema ( se non è un tuo dubbio personale ) così vediamo se c'è qualcosa di anomalo o qualcosa che ho trascurato. Ultima modifica di hibone : 09-11-2007 alle 18:18. |
|
|
|

|
|
|
#30 |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
ma infatti chi ha detto questo?
|
|
|

|
|
|
#31 |
|
Senior Member
Iscritto dal: Jan 2006
Città: Vergate Sul Membro (MI)
Messaggi: 16538
|
mi manca un pezzo
se la pressione interna ed esterna sono uguali non succede niente. se la pressione esterna è superiore a quella interna il gas dentro si comprime fino ad eguagliarne la pressione e si ferma. se la pressione esterna è costante la pressione interna al cilindro è costante e uguale a quella esterna... è giusto?! 
|
|
|

|
|
|
#32 | |||
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
Quote:
Quote:
|
|||
|
|

|
|
|
#33 | |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
si Almeno.. così mi hanno insegnato, e così c'è scritto sui miei libri è una questione personale. dal punto di vista matematico quadra tutto, è da quello reale che non so interpretare il fenomeno.. |
|
|
|

|
|
|
#34 | |||
|
Senior Member
Iscritto dal: Jan 2006
Città: Vergate Sul Membro (MI)
Messaggi: 16538
|
Quote:
Se il pistone è libero e la pressione nel cilindro non è costante, non siamo in uno stato di equilibrio, quindi non è costante neanche la pressione esterna, perchè per essere costante deve essere in uno stato di equilibrio, questo per una trasformazione irreversibile, per la quale l'integrale che hai riportato sopra non vale. Se il cilindro è libero e poi lo blocchi e la trasformazione non è reversibile, la pressione esterna spinge il cilindro fino al blocco il gas nel cilindro raggiunge una pressione intermedia tra quella originaria e quella esterna, ma la trasformazione non è isoterma perchè non reversibile. Quote:
Quote:
dico questo perchè la definizione di lavoro deriva dall'equazione del bilancio energetico per un gas alla quale si applica la legge di stato per lo stesso gas. se poi puoi scrivere la pressione del gas in funzione di qualcos'altro bene, ma la legge dipende dalla pressione di quello stesso gas. basta che guardi come si trova l'integrale che hai riportato sopra. Ultima modifica di hibone : 09-11-2007 alle 19:34. |
|||
|
|

|
|
|
#35 | |
|
Senior Member
Iscritto dal: Jun 2004
Messaggi: 1364
|
Quote:
secondo, non puoi fare il confronto delle due aree (Pest>Pint e Pest=Pint) perchè la prima non è più una trasformazione reversibile quindi non rappresentabile nel piano pv. Ultima modifica di T3d : 09-11-2007 alle 19:44. |
|
|
|

|
|
|
#36 | ||||
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
e io che ho detto? Quote:
Per equilibrio intendo quella situazione in cui le forze agenti sul pistone sono UGUALI. Il che implica che le pressioni sono uguali. questo accade, sia per le isoterme, che per le isoterme reversibili. l'integrale che ho postato vale per le reversibili, mentre quello che ho scritto nel disegno vale per le isoterme a pressione costante che NON possone essere reversibili, ma nulla vieta che siano isoterme ( che è ben diverso da adiabatiche) Quote:
Quote:
Ultima modifica di stbarlet : 09-11-2007 alle 20:03. |
||||
|
|

|
|
|
#37 | |
|
Senior Member
Iscritto dal: Jun 2004
Messaggi: 1364
|
Quote:
insomma, il secondo grafico (quello più in alto) non rappresenta una isoterma a pressione costante. è una isobara a pressione maggiore. Ultima modifica di T3d : 09-11-2007 alle 20:09. |
|
|
|

|
|
|
#38 | |
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
Quote:
Hai frainteso il mio "integrale". intendevo quello che ho scritto nel foglio con il grafico |
|
|
|

|
|
|
#39 | |||||
|
Senior Member
Iscritto dal: Jan 2006
Città: Vergate Sul Membro (MI)
Messaggi: 16538
|
mi pare che parlassi di pistone bloccato dopo la compressione, io invece dico che se prima della compressione il pistone è bloccato etc...
Quote:
http://it.wikipedia.org/wiki/Trasformazione_isotermica poichè la temperatura è una grandezza locale e varia da punto a punto ( non è come il volume ) per poter parlare in senso assoluto di "temperatura" di un gas è necessario che esso sia in equilibrio termodinamico in modo che la temperatura sia uniforme, altrimenti si avranno scostamenti più o meno marcati rispetto ad un valore medio spostandoci nel volume del gas. (non è un problema da poco, se io devo misurare la temperatura, e questa dipende da dove la misuro, come faccio a sapere a che temperatura è il gas?! ) Quote:
Se un gas non è in equilibrio termodinamico si avranno un gradiente di temperatura e uno di pressione che generano moti convettivi nel gas Quote:
una trasformazione si dice "reversibile" perchè può essere percorsa al contrario. ciò significa che al sistema termodinamico, il gas, puoi far assumere con ordine inverso esattamente tutta la sequenza di stati di equilibrio termodinamico, assunta all'andata. Se ogni stato non è di equilibrio termodinamico significa che al ritorno devi ricreare per ogni stato all'interno del volume di gas, esattamente la stessa identica distribuzione di temperature e pressioni che si sono presentate all'andata, e la cosa è piuttosto improbabile. Per questo la trasformazione si dice irreversibile Quote:
La temperatura è costante e la pressione è costante. E il volume? V=nRT/P = ?!?! n= costante R= costante T= costante P= costante... Quote:
Un sistema di n incognite deve avere n equazioni che legano quelle n incognite per poter essere risolto. Se intuitivamente poi sai che la pressione del gas è uguale a quella esterna perchè il gas è in equilibrio termodinamico, e quindi sostituisci non vuol dire niente. La relazione da cui parti è quella ( legge di stato ) è solo riscritta ma è sempre lei. Quando calcoli l'energia dissipata da un resistore non prendi la tensione ai capi del generatore, ma quella ai capi del resistore, anche se il generatore è collegato al solo resistore. questo caso è lo stesso. Ultima modifica di hibone : 09-11-2007 alle 20:46. |
|||||
|
|

|
|
|
#40 | ||
|
Senior Member
Iscritto dal: Apr 2003
Città: Torino
Messaggi: 6840
|
è bellissimo perchè mi rispondi con cose che so benissimo
Io non sto parlando di trasformazioni reversibili, motivo per cui lasciamole fuori da discorso.Le isotermiche reversibili sono un caso particolare! Sto parlando di trasformazioni ISOTERMICHE a PRESSIONE ESTERNA COSTANTE.Non sono trasformazioni reversibili, perchè la pressione esterna è costante. Il lavoro fatto in una trasformazione isotermica in questo tipo di trasformazioni è dato da -P(esterna)ΔV. Quote:
Quote:
Ultima modifica di stbarlet : 09-11-2007 alle 21:16. |
||
|
|

|

|
| Strumenti | |
|
|
Tutti gli orari sono GMT +1. Ora sono le: 11:00.