Thread unificato e generalizzato per le richieste d'aiuto in chimica!
Esercizi, Redox, domande di teoria e tutto ciò che possa essere in qualche modo inerente alla disciplina!
Sul modello del thread di matematica
siete tutti calorosamente invitati (lo ricordate lo scantinato degli orrori di Christina e di Freeban?

)
ad usare strumenti come il LaTeX o pretty print per favorire la leggibilità dei vostri post; purtroppo rimane impossibile riuscire ad inserire nei messaggi le formule di struttura (c'è un pacchetto di LaTeX fatto apposta, ma è un vero delirio!), che - se necessario - dovranno essere inserite come immagini!
Dato che - come mi è parso di capire - la maggior parte dei problemi riguardano il calcolo del pH, mi permetto di postare una breve guida che tratti le situazioni più comuni!
Cos'è il pH
Si definisce pH il cologaritmo in base 10 della concentrazione dello ione H+ (e di tutte le sue forme solvatate):
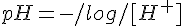
Una definizione più rigorosa vorrebbe che l'argomento del logaritmo non fosse la concentrazione di H+, ma la sua attività; per gli scopi della "miniguida" tuttavia penso non sia il caso di cacciare il culo nelle pedate: alla fine si suppone che chi si trova a dover parlare di attività sappia già perfettamente come si calcola il pH, quindi... lasciamo stare!
Il cuore del problema è quindi il calcolo della concentrazione idrogenionica!
Acidi e basi
Secondo la teoria di Bronsted-Lowry, un acido è una specie che cede H+ ad una base ed una base è un'accettore di H+. Questo significa che una specie non si comporterà da acido se non in presenza di una base e - allo stesso tempo - che una base non si comporterà da base se non in presenza di un acido.
In particolare si identificano in questo modo delle coppie acido-base coniugati, di modo che l'equilibrio in vigore sia sempre di questo tipo:
HA(acido) + B(base) ----> A-(base coniugata dell'acido HA) + BH+ (acido coniugato della base B).
Un esempio può sicuramente essere d'aiuto: prendiamo un acido come l'acido fluoridrico ed una base come l'ammoniaca. La base coniugata dell'acido fluoridrico sarà lo ione fluoruro; l'acido coniugato dell'ammoniaca sarà lo ione ammonio:
HF + NH3 ----> NH4+ + F-
Sistemi monoprotici
1) Acidi e basi forti
Per definizione di elettrolita forte, un acido o una base forte saranno completamente dissociati, dunque il loro contributo alla concentrazione idrogenionica sarà pari alla loro concentrazione. Detto questo vorrei fare comunque un esempio che dovrebbe ovviare ad alcuni malintesi:
Calcolo del pH di una soluzione 0,00000001 M di acido Cloridrico
Poiché la concentrazione di HCl è
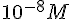
esso contribuirà in tale misura alla concentrazione di H+. Questo ovviamente non autorizza assolutamente a concludere che il pH sia 8: bisogna tener conto dell'equilibrio di autoprotolisi dell'acqua:
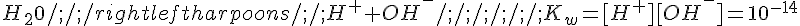
L'acido fornirà 10^-8 moli di H+, l'acqua fornirà x moli di H+ e x moli di OH- secondo l'equilibrio:
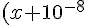x=10^{-14})
che da come soluzione x = 1,9*10^-7; facendo il logaritmo risulta pH = 6,72
 2) Acidi deboli
2) Acidi deboli (per le basi è esattamente la stessa cosa!)
Un acido debole è sottoposto ad un equilibrio di dissociazione:
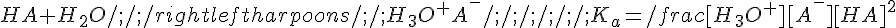
A questo punto conviene fare qualche approssimazione.
- Se l'acido è ragionevolmente forte (K > 10^-11) si può trascurare l'autoprotolisi dell'acqua: essa è già poco influente di per sé, inoltre verrà repressa dalla dissociazione dell'acido, quindi si può porre tranquillamente [H+] = [A-]
- Se l'acido non è troppo forte (K < 10^-4) né troppo diluito (Ca = concentrazione analitica dell'acido >> K_a) la frazione di acido dissociata sarà trascurabile rispetto alla concentrazione della specie indissociata: ne segue che si può porre [HA] = Ca - [H+] ~ Ca
Dunque:
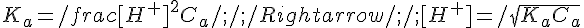
Se la seconda approssimazione non è applicabile bisogna risolvere l'equazione di secondo grado, scartando ovviamente la soluzione che verrà negativa. Ponendo H+ = x:
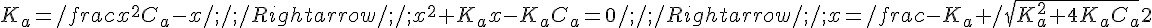 Esempio: Calcolo del pH di una soluzione 0,1M di acido Acetico (Ka = 1,8*10^-5)
Esempio: Calcolo del pH di una soluzione 0,1M di acido Acetico (Ka = 1,8*10^-5)
- la dimensione di K_a permette di utilizzare entrambe le semplificazioni, quindi, banalmente:
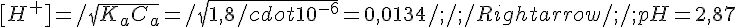 Esempio: Calcolo del pH di una soluzione 0,1M di acido Acetico (Ka = 1,8*10^-5) in acido cloridrico 0,001M
Esempio: Calcolo del pH di una soluzione 0,1M di acido Acetico (Ka = 1,8*10^-5) in acido cloridrico 0,001M
Il sistema si complica, ma non c'è nulla di nuovo: bisogna tener conto degli equilibri considerando che il contributo alla concentrazione idrogenionica dell'HCl è 0,001M! Impostando l'equilibrio (sia x=[H+] dovuto all'acido):
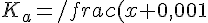x}{C_a} \;\; \Rightarrow \;\; x^2 + 0,001x - K_aC_a = 0)
Risolvendo:
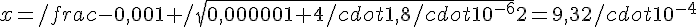
La concentrazione totale di H^+ sarà quindi la somma dei due contributi, ovvero:
[H+] = 1,93 * 10^-3
e quindi il pH sarà 2,71.
Si nota molto bene come la presenza dell'acido forte abbia un effetto notevole
sulla dissociazione dell'acido debole!
3) Idrolisi
Il comportamento dei sali in acqua non è sempre neutro: essi sono per definizione elettroliti forti, quindi si dissociano completamente, ma gli ioni che producono possono derivare da un acido o da una base deboli, che quindi sono soggetti ad un equilibrio. Si possono distinguere tre casi:
a) Sia l'anione che il catione provengono da elettroliti forti (es: NaCl)
In questo caso non ci sono problemi: la soluzione rimane neutra
b) Uno dei due ioni proviene da un elettrolita debole (ad esempio il catione è lacido coniugato di una base debole, se è viceversa la situazione è del tutto simmetrica!)
Prendiamo come modello una soluzione di concentrazione Cs di cloruro d'ammonio NH4Cl:
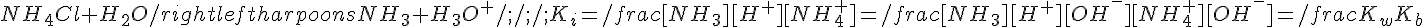
Ci si comporta quindi come se si avesse a che fare con una soluzione di un acido debole (NH4+) con costante di dissociazione
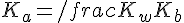
Valgono quindi tutte le considerazioni fatte sopra!
c) Entrambi gli ioni provengono da elettroliti deboli (es: NH4CN)
In questo caso la concentrazione idrogenionica è data da:
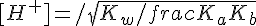
La dimostrazione è un macello... lascio decidere a voi se volete vederla!
Sistemi diprotici
Gli acidi e le basi diprotiche deboli vanno trattate esattamente come i sistemi monoprotici. Se la prima dissociazione è forte la si considera quantitativa e tanto fa, se lo è anche la seconda non ci sono problemi!
Se la prima dissociazione è forte ma la prima è debole ci si riconduce all'esercizio che ho postato sopra (acido debole in soluzione acida per acido forte): è esattamente la stessa cosa. In particolare se la costante di seconda dissociazione è relativamente piccola (< 10^-3) si può anche trascurare del tutto il fatto che tale dissociazione avvenga!
Se entrambe le dissociazioni sono deboli bisogna valutare attentamente la differenza fra le costanti. Se ci sono almeno tre ordini di grandezza di differenza, la seconda dissociazione (che viene comunque inibita dalla prima!) sarà del tutto trascurabile; altrimenti ci si riconduce al caso successivo - ovvero si tratta l'acido biprotico come un acido debole la cui costante sia pari alla media geometrica delle costanti di prima e seconda dissociazione. Il discorso sembrerà nebuloso, ma in realtà i casi in cui le costanti non differiscono di molto sono decisamente molto pochi! Ben più rilevante è il problema *del tutto analogo* (solo che uno dei due equilibri va in senso opposto) dell'idrolisi del sale di un acido biprotico del tipo NaHA (come il bicarbonato, ad esempio!).