Quote:
|
Originariamente inviato da jacopastorius
ciao,potete aiutarmi a risolvere alcuni esercizi?
1-calcolare la temparatura di ebollizione di una soluzione acquosa 0,5m di CH3OH sapendo che per l'acqua Keb.=0,56.
2-considerando il seguente equilibrio omogeneo da bilanciare
Cu + S8 -->Cu +SO2
dire come le quantità d equilibrio variano all'aumentare di
a-concentrazione di CuO
b-concentrazione d S
c-pressione che agisce sul sistema d equilibrio
|
Allora il primo esercizio è sulle proprietà colligative. Si dimostra che
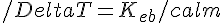
,
dove m è la molalità (moli di soluto per chilo di solvente) del soluto in questione.
Quindi la temperatura di ebollizione della soluzione di metanolo sarà
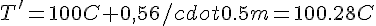
Il secondo si bilancia così:
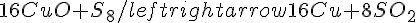
.
Per il principio di Le Chatelier, un sistema all'equilibrio reagisce ad una perturbazione in modo da assorbirla e tornare all'equilibrio: ne segue che aumentando la concentrazione di un reagente (sia CuO che S) aumenterà la concentrazione dei prodotti; poiché la reazione produce un aumento delle moli gassose (da 0 a 8!), un aumento della pressione tenderà ad ostacolarla.
__________________
"Expedit esse deos, et, ut expedit, esse putemus" (Ovidio)
Il mio "TESSORO": SuperMicro 733TQ, SuperMicro X8DAI I5520, 2x Xeon Quad E5620 Westmere, 12x Kingston 4GB DDR3 1333MHz, 4x WD 1Tb 32MB 7.2krpm
