Idrolisi del sale di un acido biprotico
In soluzione sono presenti due equilibri:
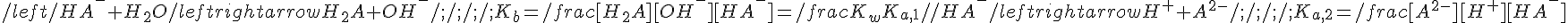
Per trovare il pH sono necessarie altre due equazioni: il bilancio di massa e il bilancio di carica; inoltre, detta Cs la concentrazione del sale, si pone [Na+] = Cs:
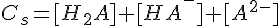
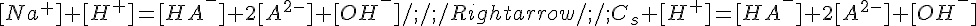
Sostituendo nella seconda equazione l'espressione di Cs che si ricava dalla prima e portando [H+] a destra:
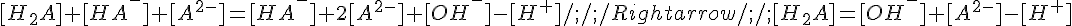
Si ricava [H2A] dalla Kb, [A2-] dalla Ka,2 e [OH-] dalla relazione fondamentale [H+][OH-]=Kw:
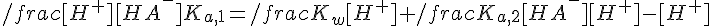
Isolando [H+]:
K_{a,1}}{C_s + K_{a.1}}})
Si possono ora fare alcune semplificazioni:
- Se K_b e la seconda costante acida sono ragionevolmente piccole si può porre [HA-] = Cs;
- La prima costante acida sarà molto minore di Cs
- Kw sarà molto minore di Cs*Ka,2
Dunque, eliminando tutti i termini molto piccoli:
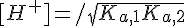
Direi che i sistemi più comuni sono questi... ovviamente sono aperto a qualsiasi richiesta!
Buon lavoro!
__________________
"Expedit esse deos, et, ut expedit, esse putemus" (Ovidio)
Il mio "TESSORO": SuperMicro 733TQ, SuperMicro X8DAI I5520, 2x Xeon Quad E5620 Westmere, 12x Kingston 4GB DDR3 1333MHz, 4x WD 1Tb 32MB 7.2krpm
